封闭
由于选择膜是根据其结合蛋白质的能力,而且抗体和靶标都是蛋白质,因此必须采取措施防止膜和用于检测靶蛋白的抗体之间的相互作用。阻断非特异性结合是通过将膜放置在稀释的蛋白质溶液中来实现的-通常是3-5%的牛血清白蛋白(BSA)或脱脂牛奶(两者都是便宜的),在tris缓冲盐水(TBS)或I-Block中,加入一点儿百分比(0.1%)的洗涤剂,如Tween 20或Triton X-100。虽然脱脂干牛奶因其可获得性而成为首选,但需要适当的封闭溶液,因为并非牛奶中的所有蛋白质都与所有检测条带相容。稀释溶液中的蛋白质附着在膜上目标蛋白质没有附着的地方。因此,当加入抗体时,它不能与膜结合,因此唯一可用的结合位点是特定的靶蛋白。这减少了western blot最终产物的背景,导致更清晰的结果,并消除了假阳性。
孵育
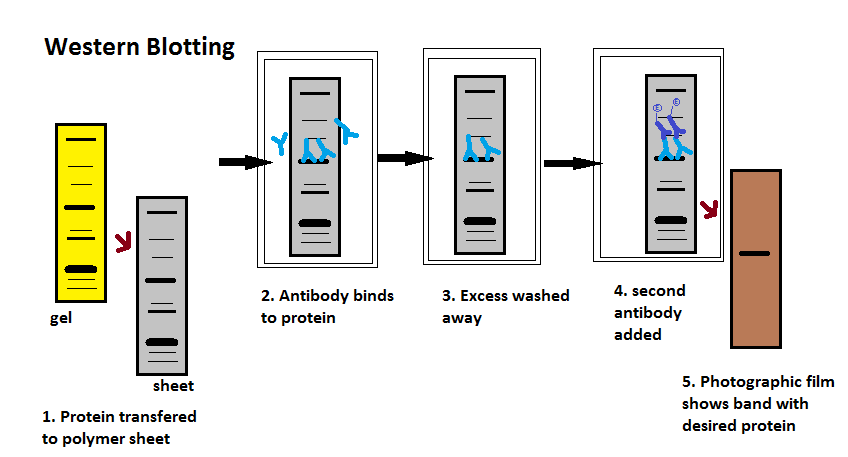
在检测过程中,用连接到报告酶的修饰抗体对膜进行“探针”以寻找感兴趣的蛋白质;当暴露于适当的底物时,这种酶驱动比色反应并产生颜色。由于各种原因,这一过程传统上是两步进行的,尽管现在有一些用于某些应用的一步检测方法。
一抗
当宿主或免疫细胞培养物暴露于感兴趣的蛋白质(或其一部分)时会产生一抗。正常情况下,这是免疫反应的一部分,而在这里,它们被收集并用作直接结合蛋白质的敏感和特异的检测工具。
在封闭后,用PBS或TBST洗涤缓冲液稀释的一抗溶液(通常在0.5 ~ 5 μ g /mL)在室温温和搅拌下与膜孵育,通常孵育1小时,或在4℃过夜。它也可以在不同的温度下孵育,较低的温度与较多的结合有关,既有特异性(对目标蛋白,即“信号”),也有非特异性(“噪声”)。孵育后,膜在洗涤缓冲液中洗涤几次,以去除未结合的一抗,从而减少背景干扰。通常,洗涤缓冲液是由缓冲盐水溶液和一小部分洗涤剂组成,有时也用奶粉或牛血清白蛋白。
二级抗体
在冲洗膜以去除未结合的一抗后,膜暴露于另一种称为二抗的抗体。抗体来自动物来源(或动物源杂交瘤培养物)。二抗识别并结合一抗的物种特异性部分。因此,抗小鼠二抗几乎可以与任何小鼠来源的一抗结合,并且可以被称为“抗物种”抗体(例如抗小鼠、抗山羊等)。为了检测目标蛋白,二抗通常与生物素或报告酶(如碱性磷酸酶或辣根过氧化物酶)连接。这意味着几个二抗将与一个一抗结合并增强信号,从而允许检测比单独使用SDS-PAGE可见的低得多的浓度的蛋白质。
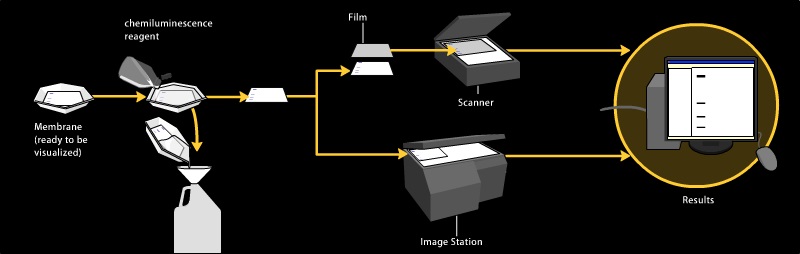
辣根过氧化物酶通常与二抗相连,通过化学发光来检测目标蛋白。化学发光底物被辣根过氧化物酶裂解,产生发光。因此,发光的产生与辣根过氧化物酶偶联二抗的量成正比,因此,间接测量目标蛋白的存在。将感光胶片贴在膜上,暴露在反应产生的光下,就会产生与印迹结合的抗体的图像。一种更便宜但敏感度较低的方法是使用含有1%过氧化氢的4-氯萘酚染色;过氧化物自由基与4-氯萘酚的反应会产生一种深紫色的污渍,无需使用专门的摄影胶片就可以拍摄。
与ELISPOT和ELISA程序一样,酶可以提供底物分子,底物分子将被酶转化为在膜上可见的彩色反应产物(见下图蓝色带)。
二抗检测的另一种方法利用近红外荧光团连接抗体。荧光染料激发产生的光是静态的,这使得荧光检测更精确,更准确地测量由与蛋白质结合的标记抗体产生的信号差异。与化学发光相比,不同数量的蛋白质在膜上产生的信号是在静态状态下测量的,而化学发光是在动态状态下测量的,因此蛋白质可以精确地量化。
第三种选择是使用放射性标记,而不是与二抗偶联的酶,例如用碘的放射性同位素标记抗体结合蛋白,如葡萄球菌蛋白A或链亲和素。由于其他方法更安全、更快、更便宜,这种方法现在很少使用;然而,这种方法的一个优点是基于自动放射成像的灵敏度,当与光学软件(例如Optiquant)结合使用时,可以实现高度精确的蛋白质定量。
一步法
从历史上看,探测过程分两步进行,因为在单独的过程中相对容易产生一抗和二抗。这给研究人员和公司在灵活性、降低成本方面带来了巨大的优势,并为检测过程增加了一个放大步骤。然而,鉴于高通量蛋白质分析和较低检测限的出现,人们一直对开发一步探测系统感兴趣,这将使该过程更快,耗材更少。这需要一种探针抗体,它既能识别感兴趣的蛋白质,又含有可检测的标签,探针通常用于已知的蛋白质标签。初级探针与膜以类似于初级抗体的方式在两步过程中孵育,然后在一系列洗涤步骤后准备直接检测。
检测和可视化
Western blot chemiluminescent detection
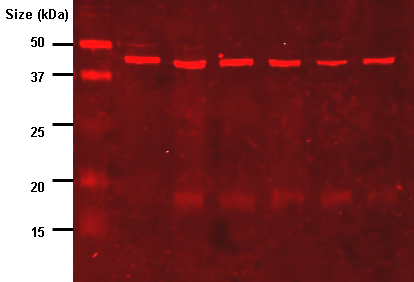
洗去未结合的探针后,western blot就可以检测标记并结合到目标蛋白上的探针了。实际上,并不是所有的western蛋白都只在膜上的一个条带上显示蛋白质。通过将染色带与电泳期间加载的标记物或阶梯的条带进行比较,可以获得大小近似。对于结构蛋白,如肌动蛋白或微管蛋白,这个过程通常是重复的,在不同的样品之间不应该改变。靶蛋白的量归一化为结构蛋白,以进行组间控制。一种较好的方法是用三氯乙醇或皮锥酮对总蛋白进行归一化。这种做法确保在错误或不完全转移的情况下对膜上总蛋白的量进行校正。(见western blot归一化)
比色法检测
比色检测方法依赖于western blot与与二抗结合的报告酶(如过氧化物酶)反应的底物的孵育。这将可溶性染料转化为一种不同颜色的不溶性形式,沉淀在酶旁边,从而染色膜。然后通过洗掉可溶性染料来阻止斑点的形成。通过密度测定法(染色强度)或分光光度法评估蛋白质水平。
化学发光检测
化学发光检测方法依赖于western blot与底物的孵育,底物在暴露于二抗上的报告基因时将发光。然后由CCD照相机捕捉到西方印迹或照相胶片的数字图像。由于图像的非线性(定量不准确),胶片在western blot检测中的应用正在逐渐消失。通过密度测定法对图像进行分析,该方法评估蛋白质染色的相对量,并根据光密度对结果进行量化。较新的软件允许进一步的数据分析,如分子量分析,如果使用适当的标准。
放射性探针
放射性标记不需要酶底物,而是允许将医用x射线胶片直接放置在western blot上,当它暴露在标记上时,会产生与感兴趣的蛋白质带对应的暗区域(见上图)。放射性检测方法的重要性正在下降,因为它的危险辐射,因为它非常昂贵,健康和安全风险高,ECL(增强化学发光)提供了一个有用的替代方案。
荧光探针
使用利什曼原虫主要提取物中的抗硫辛酸一抗和红外染料标记的二抗进行Western blot。
荧光标记的探针被光激发,然后由光敏传感器(如配备适当发射滤波器的CCD相机)检测激发的发射,该传感器捕获western blot的数字图像,并允许进一步的数据分析,如分子量分析和定量western blot分析。荧光被认为是最好的定量方法之一,但其灵敏度低于化学发光。
二级探针
硝化纤维素膜和PVDF膜之间的一个主要区别在于,它们都能支持“剥离”抗体,并将膜用于后续的抗体探针。虽然有完善的方案可用于剥离硝化纤维素膜,但更坚固的PVDF允许更容易剥离,并且在背景噪声限制实验之前更多地重复使用。与硝化纤维不同的是,PVDF在使用前必须浸泡在95%的乙醇、异丙醇或甲醇中。PVDF膜在使用过程中也往往更厚,更耐损坏。
最低要求规范
为了保证Western blots结果的可重复性,报告上述各项参数是很重要的,包括标本制备、用于上样的蛋白质浓度、凝胶百分比和运行条件、各种转移方法、尝试阻断条件、抗体浓度以及鉴定和定量测定方法。许多已经发表的文章并没有涵盖所有这些变量。因此,描述不同的实验环境或参数以提高WB的重复性和精度是至关重要的。为了增加WB的可重复性,因此需要一个最小的报告标准。



 客服1
客服1  客服2
客服2