实验流程
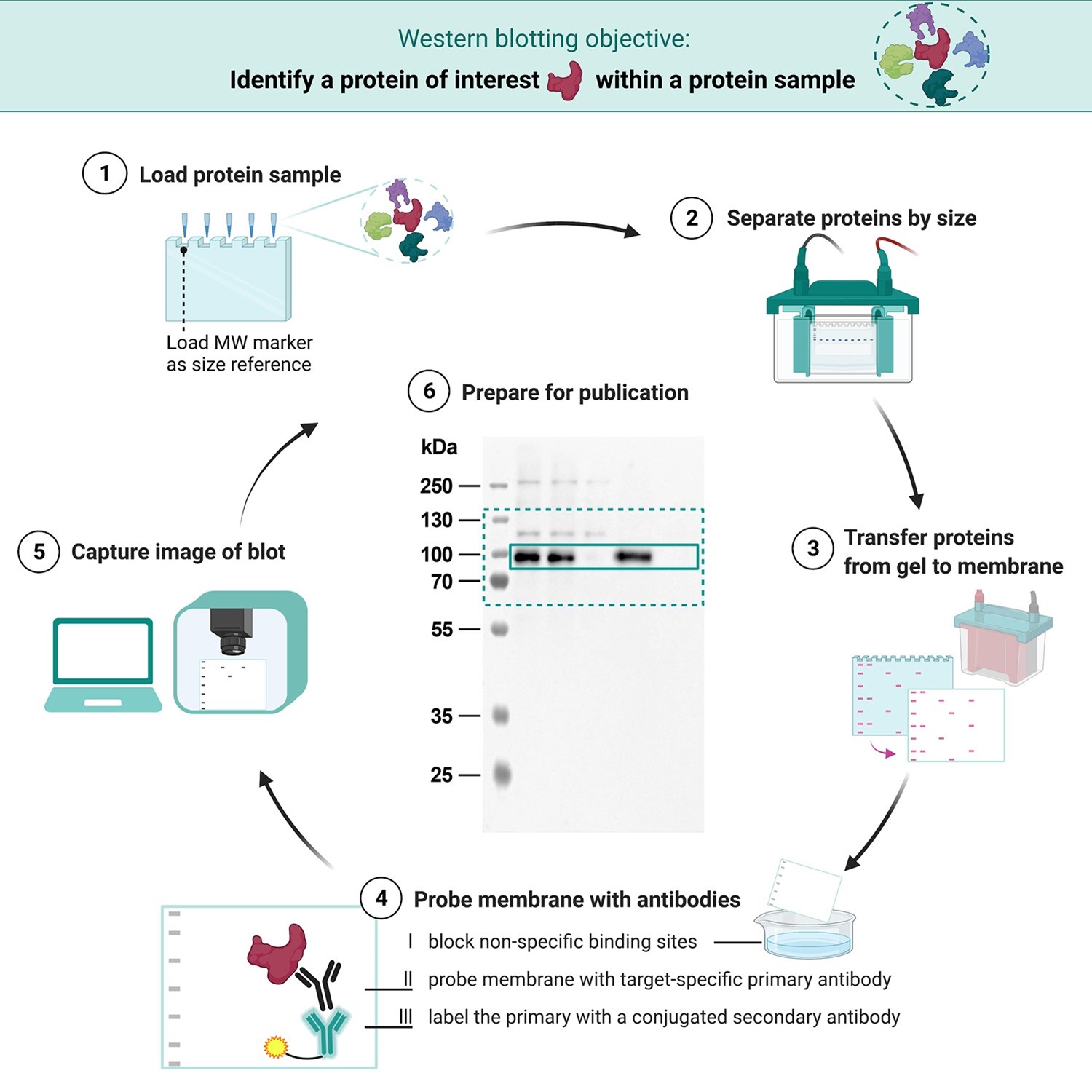
从凝胶到发表
western blot方法由凝胶电泳组成,通过3D结构分离天然蛋白质或通过多肽长度分离变性蛋白质,然后电泳转移到膜上(主要是PVDF或硝化纤维素),免疫染色程序在印迹膜上显示特定蛋白质。SDS-PAGE通常用于蛋白质的变性电泳分离。SDS通常用作缓冲液(以及凝胶),以便使所有蛋白质呈现均匀的负电荷,因为蛋白质可以带正电荷、负电荷或中性电荷。这种类型的电泳称为SDS-PAGE (SDS -聚丙烯酰胺凝胶电泳)。在电泳之前,蛋白质样品通常被煮沸以使存在的蛋白质变性。这确保了蛋白质是根据大小分离的,并防止蛋白酶(分解蛋白质的酶)降解样品。电泳分离后,蛋白质被转移到膜上(通常是硝化纤维素或PVDF)。然后通常用Ponceau S染色膜,以便在印迹上看到蛋白质,并确保适当的转移发生。接下来用牛奶(或其他阻断剂)阻断蛋白质以防止非特异性抗体结合,然后用目标蛋白质特异性抗体染色。最后,用识别第一抗体染色的二抗对膜进行染色,然后用各种方法对其进行检测。凝胶电泳步骤包括在western blot分析中,以解决抗体的交叉反应性问题。
样品制备
作为进行蛋白质印迹的重要步骤,样品制备必须有效地进行,因为该分析实验的解析受到蛋白质制备的影响,而蛋白质制备包括蛋白质提取和纯化过程。为了实现高效的蛋白质提取,需要选择合适的均质化方法,因为其负责细胞破壁和释放细胞内成分。此外,需要理想的裂解缓冲液来获得大量的目标蛋白含量,因为缓冲液引导蛋白质溶解过程和防止蛋白质降解。样品制备完成后,就可以利用凝胶电泳来分离蛋白质含量了。
凝胶电泳
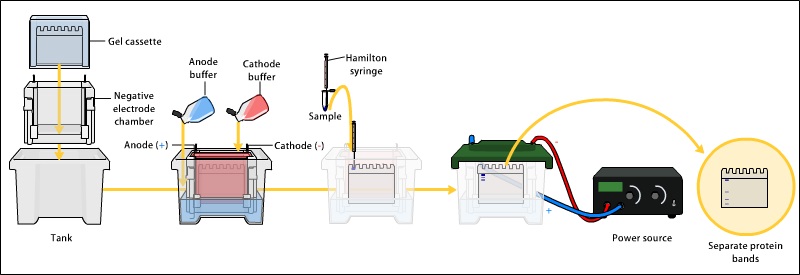
SDS-PAGE 电泳
用凝胶电泳法分离样品中的蛋白质。蛋白质的分离可以通过等电点(pI)、分子量、电荷或这些因素的组合来实现。分离的性质取决于样品的处理和凝胶的性质。
到目前为止,最常见的凝胶电泳采用聚丙烯酰胺凝胶和载有十二烷基硫酸钠(SDS)的缓冲液。SDS-PAGE (SDS -聚丙烯酰胺凝胶电泳)在多肽被强还原剂处理以去除二级和三级结构(如二硫键[S-S]到巯基[SH和SH])后,使多肽保持变性状态,从而允许通过分子质量分离蛋白质。采样的蛋白质被带负电的SDS覆盖,有效地变成阴离子,并通过凝胶的丙烯酰胺网向带正电(更高电压)的阳极(通常有一根红线)迁移。较小的蛋白质通过这种网状结构迁移得更快,因此蛋白质根据大小(通常以千道尔顿为单位,kDa)进行分离。丙烯酰胺的浓度决定了凝胶的分辨率——丙烯酰胺浓度越大,对低分子量蛋白质的分辨率越好。丙烯酰胺浓度越低,对高分子量蛋白质的分辨率越高。对于大多数印迹来说,蛋白质只能沿凝胶一维移动。
样品被装入凝胶的孔中。一条通道通常留给标记或阶梯,这是一种已知分子量的商业上可用的蛋白质混合物,通常染色以形成可见的彩色条带。当沿着凝胶施加电压时,蛋白质根据其大小以不同的速度迁移。这些不同的前进速率(不同的电泳迁移率)在每条车道内分成不同的条带。然后可以将蛋白质带与阶梯带进行比较,从而可以估计蛋白质的分子量。
也可以使用二维凝胶将单个样品中的蛋白质扩散到二维空间。蛋白质在第一个维度上是根据等电点(pH值为它们带中性净电荷时)来分离的,在第二个维度上是根据它们的分子量来分离的。
转膜
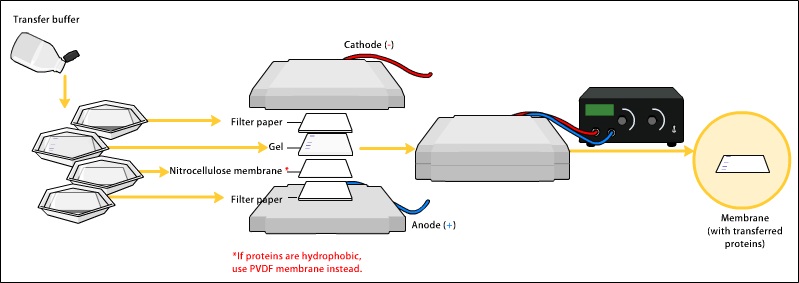
Western blot 转膜
为了使抗体检测到蛋白质,它们从凝胶内部移动到膜上,这是该过程的重要组成部分。有两种类型的膜:硝化纤维(NC)或聚偏二氟乙烯(PVDF)。NC膜对蛋白质具有较高的亲和力和保留能力。然而,NC是脆的,并且不允许印迹被用于重新探测,而PVDF膜允许印迹被重新探测。最常用的转移蛋白质的方法被称为电印迹法。电印迹法使用电流将带负电荷的蛋白质从凝胶中拉向带正电荷的阳极,并进入PVDF或NC膜。蛋白质从凝胶内移动到膜上,同时保持它们在凝胶内的组织。一种较老的转移方法是在凝胶上面放一层膜,再在上面放一叠滤纸。整个堆栈被放置在缓冲溶液中,缓冲溶液通过毛细管作用向上移动,将蛋白质带到了纸上。由于该方法的操作时间较长,在实践中并不常用。
作为任何一种转移过程的结果,蛋白质暴露在薄膜层上以供检测。选择这两种膜是因为它们的非特异性蛋白质结合特性(即结合所有蛋白质的能力相同)。蛋白质结合是基于疏水相互作用,以及膜和蛋白质之间的带电相互作用。硝化纤维膜比聚偏氟乙烯便宜,但更脆弱,不能承受反复的探测。
总蛋白染色液
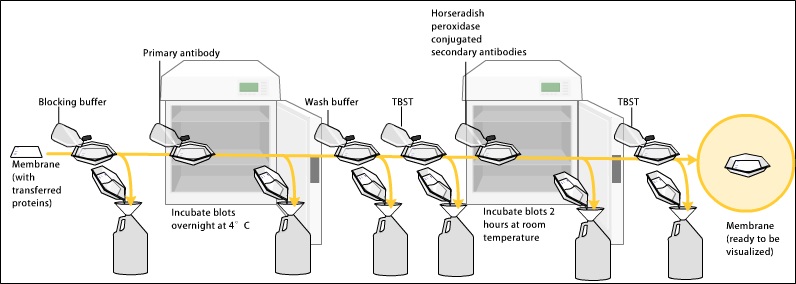
Western blot 结合
总蛋白染色可以使成功转移到膜上的总蛋白可视化,允许用户检查蛋白质转移的均匀性,并使用每道的实际蛋白质量对目标蛋白进行后续归一化。在经典的方法中,所谓的“负载控制”的归一化是基于清洁蛋白的免疫染色,但由于多重好处,最近正朝着总蛋白染色的方向发展。至少有七种不同的总蛋白染色方法被描述用于western blot归一化:Ponceau S,无染色技术,Sypro Ruby, Epicocconone, comasassie R-350, Amido Black和Cy5。为避免信号噪声,在膜阻断前应进行总蛋白染色。然而,抗体后染色也有描述。



 客服1
客服1  客服2
客服2